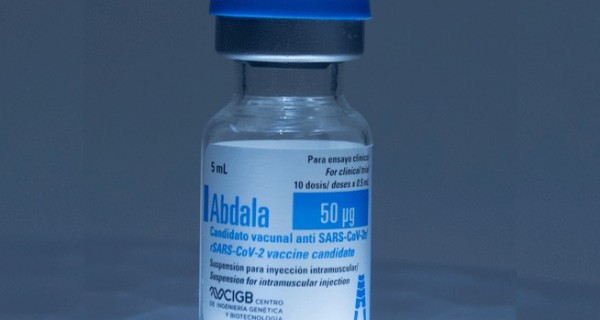
Mientras Cuba afirma haber creado la primera vacuna contra el COVID-19 de Latinoamérica, llamada Abdala, expertos del mundo académico y científico en Venezuela todavía la consideran como un candidato vacunal: aún debe cumplir requisitos.
por Mariana Souquett Gil | @nanasouquett / Efecto Cocuyo
Su pronta aplicación en Venezuela a miles de ciudadanos generó alarma entre la Academia, los ciudadanos y organizaciones de la sociedad civil, que claman por una vacunación fundamentada en evidencias y estudios sometidos a revisión por expertos.
¿Qué se sabe hasta ahora sobre Abdala y por qué todavía no se considera una vacuna en Venezuela? Estas son ocho claves:
1-¿En qué consiste Abdala?
Abdala, llamada así en homenaje a un poema de José Martí, es producida por el Centro de Ingeniería Genética y Biotecnología (Cigb) de Cuba, institución fundada hace 35 años. Su vacuna más famosa es la recombinante contra la Hepatitis B, utilizada en el plan de inmunización de Cuba desde 1992.
Para el COVID-19, Abdala se ideó como una vacuna de subunidad proteica: representa una parte de la proteína S del coronavirus SARS-CoV-2, que es la base de todas las vacunas contra COVID-19, el Receptor Binding Domain (RBD), o dominio que se adhiere al receptor. En este caso, se produce por ingeniería genética en células de levadura Pichia pastoris.
Cuba seleccionó esta levadura por ser una plataforma más barata en relación con otras, lo que según el Cigb facilitaría su producción. Además se administra con hidróxido de aluminio, un adyuvante común, y con un esquema de tres dosis (0-14-28 días) para potenciar la baja inmunogenicidad (poca capacidad de inducir anticuerpos) del RBD.
La principal diferencia de Abdala con los otros candidatos vacunales de Cuba es el uso de las células de levadura, pues los otros candidatos Soberana 01, Soberana 02 y Soberana Plus se producen en células de mamíferos.
El pasado 21 de junio, Cuba informó que Abdala obtuvo 92,28% de eficacia en la última fase de los ensayos clínicos.
2-¿Tiene autorización?
Solo tiene aprobación pública en Cuba. Es el primero de los cinco candidatos vacunales de la isla en recibir la autorización de uso de emergencia de parte del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (Cecmed), la agencia reguladora de Cuba, otorgada el pasado 9 de julio.
Además de los ensayos de fase 3, Cuba había comenzado a administrar Abdala en un estudio de intervención poblacional. Buscaba evaluar en 124.000 participantes los efectos de la vacunación con Abdala en personas con alto riesgo de infectarse, enfermarse y transmitir el virus. Luego se amplió a más personas antes de recibir la aprobación del Cecmed.
“Cuba estaba administrando Abdala en algo que ellos han denominado intervención de salud pública basados en los datos de seguridad de la fase 2, en los datos de inmunogenicidad de la fase 2, en los datos de seguridad que se reafirman al inicio de la fase 3, y basados en una ley del Ministerio de Salud Pública de Cuba que le permite al Ministerio realizar intervenciones de salud cuando hay emergencia sanitaria en el país”, indicó a Efecto Cocuyo el microbiólogo cubano y doctor en Ciencias Biológicas, Amílcar Pérez Riverol.
Sin acuerdos bilaterales y sin incorporación a mecanismos globales como Covax, la isla depende de vacunas de fabricación propia para inmunizar a su población y ahora espera venderlas a más países. Para Cuba, según Pérez Riverol, ya es una vacuna cuya seguridad se demostró a partir de las fases 1 y 2 y se reafirmó junto a la eficacia en fase 3.
Cuba aprueba uso de emergencia de su vacuna Abdala
3-¿Hay estudios publicados?
Aunque Cuba ya considera a Abdala una vacuna que puede usarse masivamente, en otros países aún esperan más información. Una de las principales razones de la desconfianza de la comunidad sobre Abdala es la ausencia de estudios publicados en revistas científicas arbitradas.
“No hay ninguna publicación científica con los resultados de Abdala. Lo que han dicho los líderes científicos del proyecto es que están preparando los artículos y que serán enviados o ya fueron enviados. Pero hasta ahora no hay ninguna publicación científica con los datos de los ensayos clínicos”, dijo Pérez Riverol, exinvestigador del Cigb y actual investigador de la Universidad Estatal Paulista en Brasil.
Además de los anuncios de los líderes del Cigb y de las autoridades cubanas, solamente existe una prepublicación no revisada por pares, difundida el pasado 3 de julio.
Pérez Riverol resalta el esfuerzo de los científicos cubanos, que suman décadas de experiencia en la elaboración y evaluación de vacunas propias, aunque afirma que se necesita publicar los hallazgos en revistas científicas arbitradas para dar más credibilidad.
4-¿Está aprobada por la OMS?
El pasado 30 de junio, el subdirector de la Organización Panamericana de la Salud (OPS), Jarbas Barbosa, recordó que Abdala no cuenta con la autorización de uso de emergencia de la OMS e invitó a los productores a publicar los resultados de sus estudios en revistas científicas para que la comunidad científica pueda evaluar y conocer los datos.
Barbosa también exhortó a los desarrolladores a solicitar la autorización de la OMS, lo que les permitiría en un futuro poder ofrecer sus vacunas en el mecanismo Covax.
“Para eso va ser necesaria una inspección, para certificar que la producción está de acuerdo con las buenas prácticas de vacunas, y también una evaluación completa y detallada de todos los ensayos clínicos de fase 1, 2 y 3″, indicó Barbosa.
Los países no necesitan la aprobación de la OMS como paso previo para poder aplicar cualquier vacuna en su territorio. Sin embargo, las autoridades sanitarias de cada país deben aprobar los ensayos clínicos, los productos e informar a la población. Según Barbosa, es importante que los entes reguladores de cada país informen de manera transparente.
Hasta este 13 de julio, Abdala figuraba en el resumen de la OMS sobre el avance de las vacunas contra el COVID-19 en el mundo como uno de los 36 candidatos vacunales de subunidad proteica. Abdala, cuyo nombre científico es CIGB-66, aparece en fase 3 de los ensayos clínicos.
OPS insta a publicar datos de la vacuna Abdala y a informar con transparencia
5-¿Y qué pasa en Venezuela?
En marzo, el mandatario Nicolás Maduro anunció que Venezuela participaría en la última fase de los ensayos clínicos de Abdala y Soberana 02. Dos días después, afirmó que el país esperaba comenzar en julio la inmunización masiva con Abdala.
Además, su gestión indicó en abril que la planta de la Empresa Socialista para la Producción de Medicamentos Biológicos (Espromed Bio), ubicada en la Ciudad Universitaria de Caracas, comenzaría la producción de Abdala.
Pero el 24 de junio llegó el primer lote de dosis de Abdala al país y la vicepresidenta Delcy Rodríguez firmó un acuerdo para adquirir 12 millones de dosis. Informó que Abdala se incorporaba así “al proceso de inmunización y al plan de vacunación”.
Solo dos días después, sin anuncios públicos de la autoridad reguladora del país, el Instituto Nacional de Higiene Rafael Rangel (Inhrr), empezaron a aplicar el producto en denominadas “jornadas de vacunación” a personas en el urbanismo Ciudad Tiuna, en el complejo militar Fuerte Tiuna, Caracas.
Pedro Almenares, representante del grupo farmacéutico Biocubafarma en Venezuela, aseguró el 3 de julio a Radio Nacional de Venezuela que el primer cargamento se trató de una donación como “antesala” al acuerdo firmado por ambos países. Además informó que vacunaron a 10.000 personas con la primera dosis hasta el 1 de julio.
“Se establecieron tres centros de vacunación con 16 puestos para vacunación. Esto permitió que en cinco días se pudieran vacunar 10.000 venezolanos de forma organizada”, expresó Almenares. Previamente, según recoge la agencia Reuters, Almenares informó que se trataba de un estudio para evaluar las reacciones a las dosis y aseguró que para ello tenían aprobación de las autoridades.
En Venezuela, de acuerdo con videos de cadenas como Telesur, se convocó a las personas a recibir el producto afirmando que Abdala estaba aprobada por la Organización Mundial de la Salud.
No solo acudieron habitantes de Ciudad Tiuna. Hasta Fuerte Tiuna fueron convocados guardaparques del Instituto Nacional de Parques (Inparques).
“Les dijeron que era la vacuna cubana y nunca les dijeron que estaba en estudio. Algunos se la pusieron y otros se negaron”, reportó a Efecto Cocuyo el Sindicato Unitario Nacional de Empleados Públicos del Instituto Nacional de Parques (Sunepinparques).
6-¿Por qué para los expertos venezolanos aún no es una vacuna?
Ya el 30 de junio, las siete Academias Nacionales de Venezuela alertaban que todavía consideraban a Abdala un producto experimental. La razón era la ausencia de aprobación de la agencia regulatoria de medicamentos en el país y de su evaluación por pares internacionalmente reconocidos.
También se pronunciaron la Sociedad Venezolana de Infectología (SVI), la Sociedad Venezolana de Puericultura y Pediatría (Svpp), Médicos Unidos de Venezuela (MUV), la Asociación de Investigadores del Instituto Venezolano de Investigaciones Científicas (AsoInIvic), la asociación civil Centro Nacional de Bioética (Cenabi) y las organizaciones de la sociedad representadas en el Foro Cívico.
“Abdala, Soberana 02 y EpicVacCorona, por ser todavía candidatos vacunales, no deben ser administrados como parte de un esquema de vacunación masivo. Solo pudieran ser usadas en la actualidad bajo la modalidad de ensayo clínico, con la selección de voluntarios que firmen un consentimiento informado para participar en un estudio con aval científico y ético”, alertó la SVI el pasado 2 de julio.
Venezuela inicia ensayos de la EpiVacCorona con el embajador ruso como primer voluntario
Tras la aprobación de emergencia del Cecmed de Cuba, la posición de los expertos de Venezuela se mantiene. Así lo indicó a Efecto Cocuyo el virólogo venezolano José Esparza, profesor del Instituto de Virología Humana de la Universidad de Maryland, Estados Unidos, y miembro correspondiente extranjero de la Academia Nacional de Medicina.
“La decisión del Cecmed es eminentemente política y no cambia nuestra posición que se basa en la ausencia de datos publicados de las fases clínicas. La resolución del Cecmed tampoco aporta esa información”, dijo.
El Cenabi, por su parte, también ratificó la advertencia publicada el pasado 26 de junio: sus integrantes están en desacuerdo con la aplicación de Abdala sin informar a la población sobre su uso como producto experimental y sin consentimiento informado.
“La autorización del Cecmed no cambia nuestra posición. Es un ente local y no un ente de reconocimiento internacional como lo puede ser la OMS o la agencia de un país que de reconocida seriedad”, respondió Gladys Velásquez, presidenta del Cenabi, a Efecto Cocuyo.
7-¿Se violan los protocolos?
Una de las principales alertas por el uso de Abdala en Venezuela fue la administración de las dosis sin informar a la población y sin solicitar consentimiento informado, comprensible y por escrito, necesario para participar en ensayos clínicos en humanos. Según los expertos, la manera en la que el país comenzó a poner las dosis incumple los principios éticos y legales del país.
“Hay mucha confusión sobre el uso de Abdala en Venezuela. La ausencia de información del Instituto Nacional de Higiene contribuye a la confusión. Se nos informó que Abdala se incorporaría a los planes nacionales de vacunación a pesar de que no era (o es) una vacuna avalada por autoridades regulatorias creíbles o por la OPS/OMS”, explicó el virólogo José Esparza.
“Luego se dijo que la Abdala se estaba usando en una prueba clínica en Venezuela. Eso requeriría la aprobación de un protocolo de experimentación y que se siguieran ciertos requerimientos éticos. Nada de eso sucedió”, añadió el experto en vacunas.
Gladys Velásquez, presidenta del Cenabi, destacó que es normal probar las vacunas candidatas en poblaciones, pero afirmó que esto siempre debe hacerse previa aprobación por un Comité de Bioética local y con el consentimiento informado de todos los participantes con capacidad para decidir.
“Existen normas internacionales que son de obligada aplicación en todo el mundo, como la Declaración de Helsinki, las normas del Consejo de Organizaciones Internacionales de Ciencias Médicas (Cioms) en colaboración con la Organización Mundial de la Salud (OMS), y hay otras que son Normas de Buenas Prácticas Clínicas. Siempre se dice que para probar cualquier medicamento o producto tiene que haber el consentimiento informado y aprobación ética por un comité“, dijo Velásquez.
En Venezuela, la sociedad civil, académicos y otras organizaciones han solicitado que se investigue la situación de manera imparcial y que se apliquen las sanciones correspondientes a los funcionarios involucrados en la realización de ensayos clínicos en humanos “en desacato a principios, marco jurídico y normativo nacional e internacional”.
8-¿Y sobre su aplicación en niños?
El 1 de julio, Cuba autorizó el inicio del ensayo clínico en población pediátrica, llamado Ismaelillo, que involucra a 592 niños y adolescentes entre 3 y 18 años de edad. Ese mismo día, tras el anuncio de Cuba, Nicolás Maduro asomó nuevamente la posibilidad de volver a clases presenciales en todos los niveles para el mes de octubre.
“Es bien probable para octubre el ensayo clínico esté completo, y es probable que podamos empezar a vacunar a los muchachos de las escuelas y los liceos. Vamos a empezar a avanzar en un plan perfecto“, dijo en una transmisión televisiva.
La Academia Nacional de Medicina y la Sociedad de Pediatría exhortaron a utilizar en el país solo vacunas aprobadas y no prototipos vacunales. El Centro Nacional de Bioética también expresó preocupación por el uso del producto en niños, niñas y adolescentes.
“Se dice que se va a aplicar a los niños , pero si no tenemos clara la situación del producto con los adultos, ¿cómo será con los niños que son población vulnerable? Si no puedes hacerlo de manera adecuada en adultos, muchos menos en niños que son vulnerables, no pueden decidir por sí solos y que su organismo esta en proceso de desarrollo”, indicó la presidenta del Cenabi.